Verlauf der Dampfdruckkurve
Betrachten wir den Phasenübergang von einer Phase A auf eine andere Phase B. Die Phase A habe zunächst das Volumen VA . Nach der Umwandlung in die Phase B hat sich dieses auf VB geändert. Ganz allgemein ist die Steigung der Koexistenzkurve pk(T) beider Phasen im pT-Diagramm durch die Clausius-Clapeyronsche Gleichung gegeben:
![]()
Hierbei bezeichnet QL die molare latente Wärme des Phasenübergangs und n die Anzahl der betrachteten Mole des Stoffes. Da im allgemeinen VB > VA , ist die Steigung in der Regel positiv.
Beim Prozess des Verdampfens müssen wir die flüssige (Phase B) und die gasförmige Phase (Phase A) betrachten. Das Volumen der Gasphase VB ist sehr viel größer als das der flüssigen Phase VA, so dass wir näherungsweise
![]()
setzen können. Ferner können wir VB (für hohe Temperaturen T) mit Hilfe der allgemeinen Gasgleichung ausdrücken:
![]()
Einsetzen liefert dann
![]()
bzw.
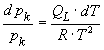
Integration mit der Randbedingung pk(T0 ) = pk0 liefert:
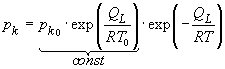
Da die ersten beiden Faktoren sind konstant sind, ist
![]() .
.
Die Dampfdruckkurve pk(T) steigt also mit der Temperatur T exponentiell an.